Das Periodensystem der Elemente¶
Periodensystem der Elemente: Periodensystem
Im Periodensystem sind die Elemente in steigender Protonenzahl ihrer Atome angeordnet. Die waagerechten Zeilen sind die Perioden. Die senkrechten Spalten sind die Gruppen.
Elemente, bei denen die Elektronen in \(s\)- und \(p\)-Orbitale der äußeren Schale eingebaut werden, heißen Hauptgruppenelemente. Elemente, bei denen die Elektronen in \(d\)-Orbitale der vorletzten Schale eingebaut werden, heißen Nebengruppenelemente. Die \(14\) Elemente mit \(Z=57\) bis \(Z=70\) heißen Lanthanoiden. Die \(14\) Elemente ab \(Z=89\) heißen Actinoiden. Bei Lanthanoiden und Actinoiden wird das \(f\)-Orbital aufgefüllt. Die Elektronenkonfiguration der Elemente bestimmt man mit Hilfe des Periodensystems.

Periodensystem der Elemente¶
Aufgabe 1
Bestimmen Sie die Elektronenkonfiguration von Calcium, Iod, Terbium und Gold.
Der Atomradius ist der halbe Abstand zweier Atomkerne eines Elements. Innerhalb der Periode nimmt der Atomradius von links nach rechts ab.
Begründung: Von links nach rechts nimmt die Kernladung zu und die Anzahl der Schalen bleibt gleich. Die gesamte Hülle wird dadurch näher an den Kern gezogen.
Innerhalb einer Gruppe nimmt der Atomradius von oben nach unten zu.
Begründung: Mit jeder neuen Periode kommt eine neue Schale dazu und dies erfordert einen größeren Platzbedarf.
Aufgabe 2
Ordnen Sie folgende Elemente vom größten zum kleinsten Atomradius. Verwenden Sie die Bezeichnungen der chemischen Elemente aus dem Periodensystem.
Barium, Beryllium, Blei, Cäsium, Iod, Kalium, Selen, Silizium, Stronzium, Tellur
Die Ionisierungsenergie ist die Energie, die aufgewandt werden muss, um ein Elektron aus dem energiereichsten Orbital zu entfernen. Durch Entfernung von Elektronen entstehen positive Ionen.
Innerhalb der Periode nimmt die Ionisierungsenergie von links nach rechts zu.
Begründung: Die Elektronen werden immer stärker vom Kern festgehalten und die Abtrennung wird dann erschwert.
Innerhalb einer Gruppe nimmt die Ionisierungsenergie von oben nach unten ab.
Begründung: Wegen des immer größer werdenden Atomradius nimmt die Anziehung der äußeren Elektronen ab.
Aufgabe 3
Ordnen Sie folgende Elemente vom der größten zur kleinsten Ionisierungsenergie. Verwenden Sie die Bezeichnungen der chemischen Elemente aus dem Periodensystem.
Arsen, Bismut, Brom, Calcium, Chlor, Lithium, Natrium, Phosphor, Rubidium, Stickstoff
Metalle haben eine geringe Ionisierungsenergie und die äußeren Schalen sind mit wenig Elektronen besetzt. In der Periode nimmt der Metallcharakter von links nach rechts ab. Innerhalb der Gruppe nimmt der Metallcharakter von oben nach unten zu. Die Gerade, die zwischen \(Be\) und \(B\) beginnt und zwischen \(Po\) und \(At\) endet, heißt Metall-Nichtmetall-Trennlinie.
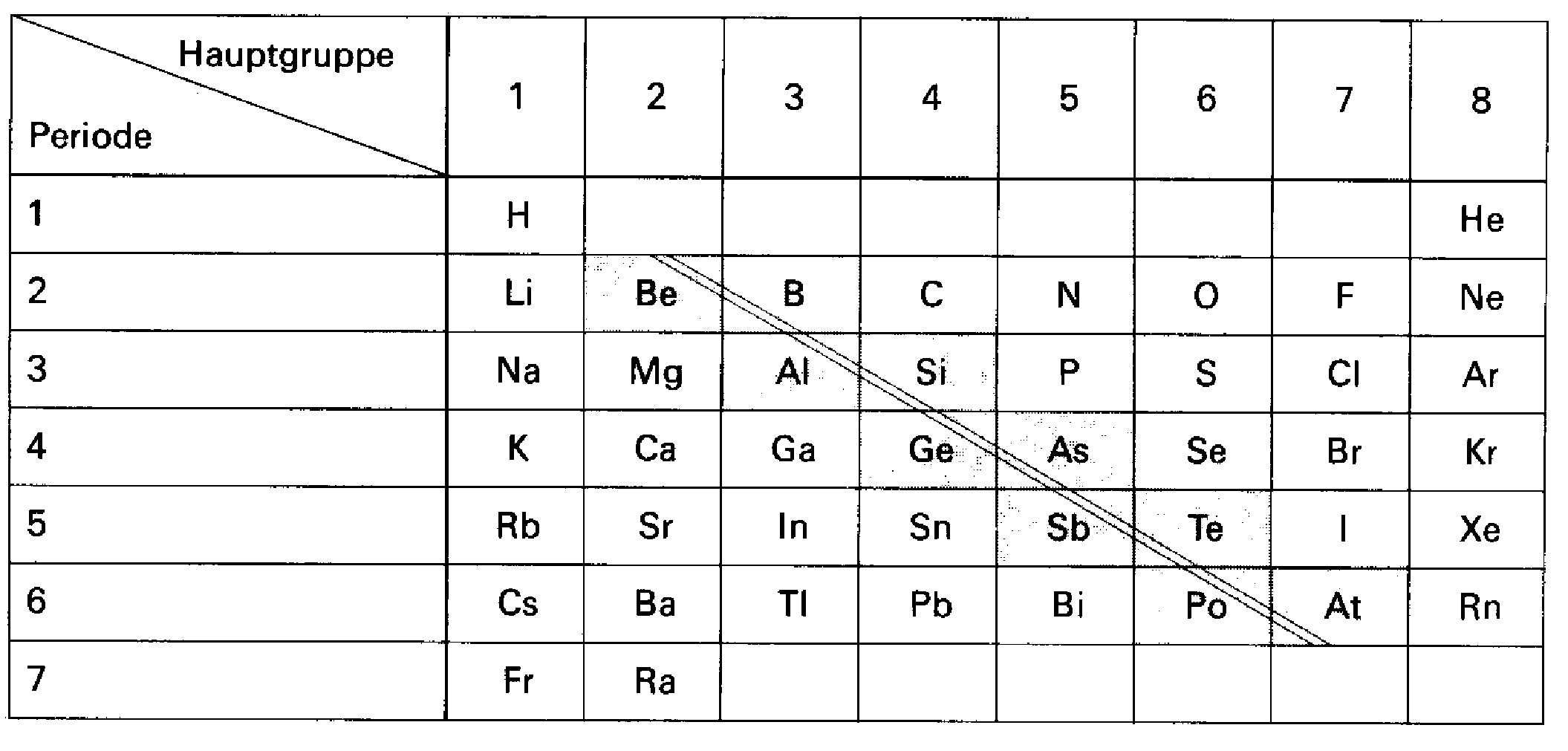
Metall-Nichtmetall-Trennlinie¶