Das Atommodell¶
Alle technischen Verfahren zur Stoffumwandlung setzen Erkenntnisse aus der Chemie ein. Beispiele sind Herstellung von Kunststoff, Stahlerzeugung, Petrochemie, Keramik. In der Chemie ist das Atom die kleinste Einheit der uns umgebenden Materie. Man stellt sich ein Atom als kleine Kugel vor. Wie halten die einzelnen Atome in einem Festkörper zusammen?
Die Bindungskräfte zwischen den Atomen setzen sich aus Abstoßungskräfte und Anziehungskräfte zusammen. Die Überlagerung dieser beiden Kräfte ergibt bei einem bestimmten Atomabstand \(r_{0}\) ein Kräftegleichgewicht.
Durch äußere Kräfte verschieben sich Atome aus ihrer Gleichgewichtslage. Gleichzeitig entstehen Rückstellkräfte, die die Atome in die Ausgangslage zurückbringen, falls die äußere Kraft verschwindet. Erst wenn die äußere Kraft einen bestimmten Betrag \(F_{\max }\) überschreitet, kehren die Atome nicht auf die Ausgangsposition zurück. Es liegt plastische Verformung oder Bruch des Festkörpers vor. Die im Festkörper wirkenden Kräfte sind elektrostatische Kräfte zwischen den Protonen im Kern und den Elektronen in der Elektronenhülle.
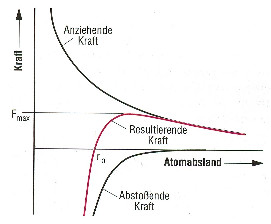
Kräftegleichgewicht¶
Im Mittelpunkt unserer Betrachtungen steht das Bohrsche Atommodell. Atome stellt man sich als kugelförmige Teilchen vor. Das Zentrum des Atoms bildet der Atomkern, der aus den positiv geladenen Protonen und den neutralen Neutronen besteht. Die Nukleonen (Protonen und Neutronen) tragen fast die gesamte Masse des Atoms. Die Summe aus Neutronen- und Protonenzahl bildet die Nukleonenzahl des Atoms. Die Elektronen bilden die negativ geladene Hülle und bestimmen damit Größe und Form des Atoms.

Atommodell¶
Der Atomkern
Die Protonenzahl bestimmt die Art des Elements. Ein Stoff, dessen Atome dieselbe Protonenzahl (Kernladungszahl, Ordnungszahl \(Z\)) haben, wird als Element bezeichnet. Stoffe, deren Atome bei gleicher Protonenzahl unterschiedliche Neutronenzahlen haben, nennt man Isotope.
Beispiel: Uran \(U235\) und \(U238\)
- \(_{92}^{235}U\) : Uran mit \(235\) Nukleonen, d. h. \(92\) Protonen und \(143\) Neutronen
- \(_{92}^{238}U\) : Uran mit \(238\) Nukleonen, d. h. \(92\) Protonen und \(146\) Neutronen
- Vorkommen: \(U235\) \(0.7\%\) und \(U238\) \(99.3\%\)
Die Elektronenhülle
Für die Eigenschaften der Stoffe sind die Elektronen verantwortlich. Chloratome mit \(17\) Elektronen in der Hülle sind äußerst aggressiv und giftig. Erhält ein Chloratom ein zusätzliches Elektron, so entsteht ein negativ geladenes Teilchen, das lebensnotwendig ist.
Die Chemie beschäftigt sich sehr genau mit der Elektronenhülle, die Orbitalmodell genannt wird. Das Orbitalmodell erfasst Anzahl, räumliche Verteilung sowie die Energie der Elektronen. Durch Berechnungen ist es gelungen in der Atomhülle des Wasserstoffatoms Räume anzugeben, in denen sich das Elektron mit sehr hoher Wahrscheinlichkeit aufhalten kann. Diese Räume werden als Orbitale bezeichnet.
Haupt- und Nebenenergieniveaus
In der Atomhülle sind für die Elektronen genau sieben Energieniveaus \(E_{1}\), \(E_{2}\), \(E_{3}\ldots\) vorhanden. Diese Energieniveaus werden als \(1\). Hauptorbital, \(2\). Hauptorbital bis \(7\). Hauptorbital bezeichnet. Ein anderer Begriff für Hauptorbital ist Hauptquant.
Die Hauptquanten sind in Nebenenergieniveaus auch Orbitale genannt, aufgespalten. Es gibt \(4\) Orbitale, die mit \(s\), \(p\), \(d\) und \(f\) bezeichnet werden. Das \(1\). Hauptorbital hat ein Orbital, das \(2\). und \(7\). Hauptorbital haben zwei, das \(3\). und \(6\). Hauptorbital haben drei und das \(4\). und \(5\). Hauptorbital haben vier Orbitale.
Das \(s\)-Orbital hat ein, das \(p\)-Orbital hat drei, das \(d\)-Orbital hat fünf und das \(f\)-Orbital hat sieben Niveaus gleicher Energie. In jedem dieser Niveaus können sich höchstens zwei Elektronen aufhalten, die sich in der Drehrichtung oder Spin unterscheiden. Orbitale gleicher Energie werden zuerst mit Elektronen gleichen Spins ausgefüllt.

Orbitalmodell¶