Die Ionenbindung¶
Voraussetzung für diesen Bindungstyp ist, dass Elektronen abgebende und Elektronen aufnehmende Atome eine Bindung eingehen. Kochsalz (\(NaCl\)) ist das bekannteste Beispiel.
Bei dieser Bindung gibt jedes \(Na\)-Atom sein Außenelektron an ein \(Cl\)-Atom ab. Die elektrisch neutralen \(Na\)-Atome werden dadurch zu postiv geladenen \(Na^{+}\)-Ionen und die \(Cl\)-Atome zu geladenen \(Cl^{-}\)-Ionen. Aufgrund dieser Ladungstrennung ergibt sich eine elektrostatische Anziehung zwischen den ungleichnamig geladenen Ionen. Ionenpaare wachsen zu einem Ionengitter zusammen.
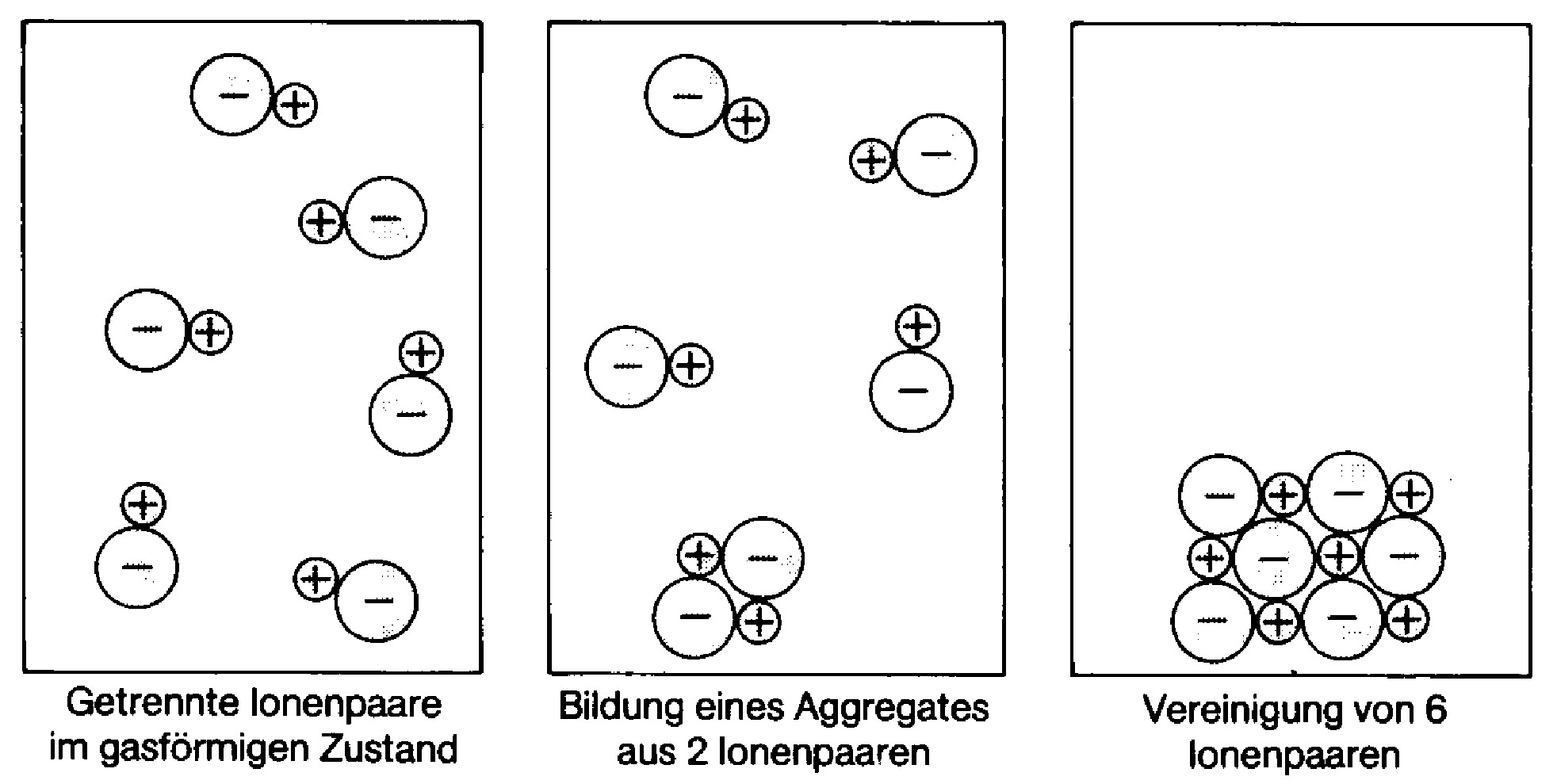
Kochsalz¶
Unterschiedliche Ionenbindungen zeigen ähnliche Gitterstrukturen. Diese Bindungsart findet man in der Oxidkeramik, z.B. \(CaO\). Die Bindungskräfte sind groß. Das hat zur Folge, dass Stoffe mit dieser Bindungsart hohe Schmelztemperaturen besitzen, da beim Aufschmelzen die Anziehungskräfte überwunden werden müssen.
Eine plastische Verformbarkeit ist nicht gegeben, weil bereits bei einer Verschiebung um nur einen Ionenabstand die Anziehung in Abstoßung übergeht. Demzufolge sind diese Stoffe auch sehr hart und spröde. Aufgrund fehlender freier Elektronen sind diese Stoffe schlechte Leiter für Elektrizität und Wärme. Ionenkristalle lassen sich nicht plastisch verformen.
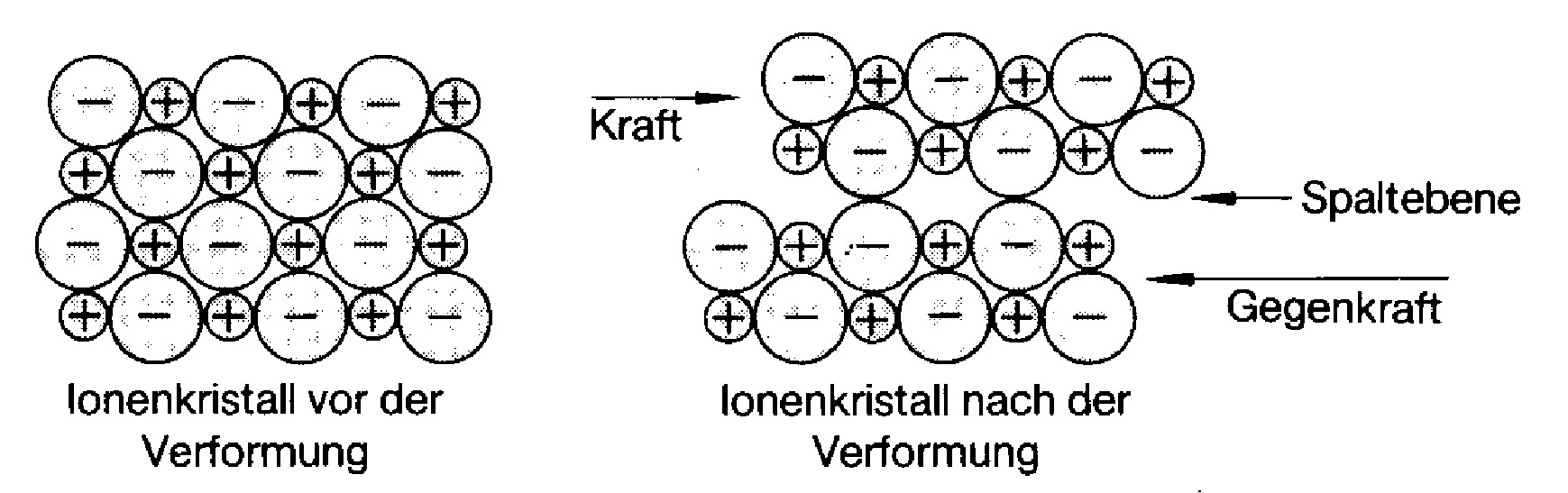
Verformung eines Inonenkristalls¶
Damit wir chemische Reaktionen aus energetischer Sicht erfassen können, ist es wichtig, dass wir wissen aus wie vielen Atomen oder Molekülen ein bestimmter Stoff besteht. Ein physikalische Größe für die Menge eines Stoffes ist das \(\mathrm{mol}\). In \(1\,\mathrm{mol}\) eines Stoffes sind \(6.0221367\times 10^{23}\) Atome oder Moleküle enthalten.
Bei der Entstehung von \(NaCl\) laufen mehrere Reaktionen ab. Die Reaktion von festem Natrium \(Na(f)\) mit gasförmigem Chlor \(Cl(g)\) zu Natriumchlorid \(NaCl\), läuft in fünf Schritten ab:
- Sublimation von Natrium (Sublimationsenergie),
- Ionisierung der Natriumatome (Ionisierungsenergie),
- Spaltung der Bindungen im Chlormolekül (Bindungsenergie),
- Bildung der Chloridionen (Elektronenaffinität),
- Bildung des Natriumchloridgitters (Gitterenergie).

Entstehung von \(NaCl\)¶
Die einzelnen Reaktionen bilden folgendes Reaktionsschema:
- \(Na(f)\rightarrow Na(g)\) ; \(\Delta E_{1}=109\,\mathrm{\frac{kJ}{mol}}\)
- \(Na(g)\rightarrow Na^{+}(g)+e^{-}\) ; \(\Delta E_{2}=502\,\mathrm{\frac{kJ}{mol}}\)
- \(1/2\,Cl_{2}(g)\rightarrow Cl(g)\) ; \(\Delta E_{3}=1/2\cdot 242\,\mathrm{\frac{kJ}{mol}}\)
- \(Cl(g)+e^{-}\rightarrow Cl^{-}(g)\) ; \(\Delta E_{4}=-365\,\mathrm{\frac{kJ}{mol}}\)
- \(Na^{+}(g)+Cl^{-}(g)\rightarrow NaCl(f)\) ; \(\Delta E_{5}=-778\,\mathrm{\frac{kJ}{mol}}\)
- Gesamtreaktion: \(Na(f)+1/2\,Cl_{2}(g)\rightarrow NaCl(f)\) ; \(\Delta E=-411\,\mathrm{\frac{kJ}{mol}}\)
Die Gesamtreaktion ist eine exoterme Reaktion, bei der die Bildungswärme \(\Delta E=411\,\mathrm{\frac{kJ}{mol}}\) frei wird.
Aufgabe 1
Berechnen Sie die Gitterenergie von Aluminiumoxid (\(Al_{2}O_{3}\)), wenn gilt:
- Sublimationswärme von Aluminium: \(326\,\mathrm{\frac{kJ}{mol}}\),
- 1. Ionisierungswärme von Aluminium: \(584\,\mathrm{\frac{kJ}{mol}}\),
- 2. Ionisierungswärme von Aluminium: \(1823\,\mathrm{\frac{kJ}{mol}}\),
- 3. Ionisierungswärme von Aluminium: \(2751\,\mathrm{\frac{kJ}{mol}}\),
- Bindungsenergie von Sauerstoff: \(498\,\mathrm{\frac{kJ}{mol}}\),
- Elektronenaffinität von Sauerstoff: \(628\,\mathrm{\frac{kJ}{mol}}\),
- Gitterenergie von Aluminiumoxid: \(\Delta E_{5}\),
- Bildungswärme von Aluminiumoxid: \(-1676\,\mathrm{\frac{kJ}{mol}}\).
Aufgabe 2
Berechnen Sie die Elektronenaffinität von Schwefel aus den folgenden Daten nachdem Sie ein geeignetes Reaktionsschema aufgestellt haben.
- Sublimationswärme von Kalium: \(90\,\mathrm{\frac{kJ}{mol}}\),
- 1. Ionisierungswärme von Kalium: \(414\,\mathrm{\frac{kJ}{mol}}\),
- 2. Ionisierungswärme von Kalium: \(3070\,\mathrm{\frac{kJ}{mol}}\),
- Sublimationswärme von Schwefel: \(279\,\mathrm{\frac{kJ}{mol}}\),
- Gitterenergie von Kaliumsulfid (\(K_{2}S\)): \(-2072\,\mathrm{\frac{kJ}{mol}}\),
- Bildungswärme von Kaluimsulfid (\(K_{2}S\)): \(-418\,\mathrm{\frac{kJ}{mol}}\).
Aufgabe 3
Bestimmen Sie die Formeln folgender ionischer Verbindungen.
- Natriumbromid: \(Na^{?}\) ; \(Br^{?}\)
- Kaliumoxid: \(K^{?}\) ; \(O^{?}\)
- Calciumchlorid: \(Ca^{?}\) ; \(Cl^{?}\)
- Lithiumsulfat: \(Li^{?}\) ; \((SO_{4})^{?}\)
- Lithiumnitrid: \(Li^{?}\) ; \(N^{?}\)
- Magnesiumnitrid: \(Mg^{?}\) ; \(N^{?}\)
- Alum.-Hydrogensulfat: \(Al^{?}\) ; \((HSO_{4})^{?}\)
- Aluminiumoxid: \(Al^{?}\) ; \(O^{?}\)
- Eisen(II)-Sulfat: \(Fe^{?}\) ; \((SO_{4})^{?}\)
- Eisen(III)-Chlorid: \(Fe^{?}\) ; \(Cl^{?}\)
- Kupfer(II)-Sulfat: \(Cu^{?}\) ; \((SO_{4})^{?}\)
- Zink(II)-Nitrat: \(Zn^{?}\) ; \((NO_{3})^{?}\)
- Calciumphosphat: \(Ca^{?}\) ; \((PO_{4})^{?}\)
- Eisen(II)-Oxid: \(Fe^{?}\) ; \(O^{?}\)
- Natriumnitrat: \(Na^{?}\) ; \((NO_{3})^{?}\)
- Kaliumchromat: \(K^{?}\) ; \((CrO_{4})^{?}\)
- Kaliumpermanganat: \(K^{?}\) ; \((MnO_{4})^{?}\)
- Lithiumhydrid: \(Li^{?}\) ; \(H^{?}\)
- Magnesiumbromid: \(Mg^{?}\) ; \(Br^{?}\)
- Ammoniumnitrat: \((NH_{4})^{?}\) ; \((NO_{3})^{?}\)
- Silber(I)-Chlorid: \(Ag^{?}\) ; \(Cl^{?}\)
- Kupfer(II)-Oxid: \(Cu^{?}\) ; \(O^{?}\)
- Eisen(III)-Oxid: \(Fe^{?}\) ; \(O^{?}\)
- Magnesiumcarbonat: \(Mg^{?}\) ; \((CO_{3})^{?}\)