Chemische Reaktionen¶
Energetik bei chemischen Reaktionen
Bei einer chemischen Reaktion findet sowohl Stoff- als auch Energieumsatz statt. Die Aktivierungsenergie ist die Energie, die man zuführen muss, damit eine Reaktion mit merklicher Geschwindigkeit einsetzt.

Aktivierungsenergie¶
Die Reaktionsenthalpie \(\Delta H\) ist der Energieumsatz einer chemischen Reaktion. Bei einer exothermen Reaktion wird Energie nach außen abgegeben, also gilt: \(\Delta H<0\). Beispiel: \(2H_{2}+O_{2}\rightarrow 2H_{2}O\) ; \(\Delta H=-285.8\,\mathrm{}\frac{kJ}{mol}\).

Exotherme Reaktion¶
Bei einer endothermen Reaktion wird Energie von außen aufgenommen, also gilt: \(\Delta H>0\). Beispiel: \(6CO_{2}+6H_{2}O\rightarrow C_{6}H_{12}O_{6}+6O_{2}\) ; \(\Delta H=+2825\,\mathrm{}\frac{kJ}{mol}\).

Endotherme Reaktion¶
Ein Katalysator ist ein Reaktionsbeschleuniger, der nach der Reaktion selbst wieder unverändert vorliegt. Die Erniedrigung der Aktivierungsenergie ist die Folge der Oberflächenwirkung eines festen Katalysators. Die Oberflächenmoleküle des Katalysators sind nur nach innen voll beansprucht, nach außen sind noch Valenzen frei. Durch diese Oberflächenkräfte werden z. B. Wasserstoffatome angezogen und aus ihren Verbindungen mit Sauerstoff getrennt.
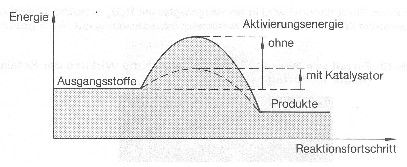
Katalysator¶
Aufgabe 1
Bei chemischen Reaktionen spielt der Stoffausgleich eine wichtige Rolle. Machen Sie den Stoffausgleich bei folgenden Reaktionen.
- \(NO+O_{2}\rightarrow NO_{2}\)
- \(CaCO_{3}+HCl\rightarrow CaCl_{2}+CO_{2}+H_{2}O\)
- \(Fe_{2}O_{3}+CO\rightarrow Fe+CO_{2}\)
- \(C_{5}H_{12}+O_{2}\rightarrow CO_{2}+H_{2}O\)
- \(NH_{3}+NO\rightarrow N_{2}+H_{2}O\)
- \(C_{6}H_{12}O_{6}+O_{2}\rightarrow CO_{2}+H_{2}O\)
- \(NH_{3}+O_{2}\rightarrow NO+H_{2}O\)
- \(PbO+C\rightarrow CO_{2}+Pb\)
- \(Fe+S\rightarrow FeS_{2}\)
- \(Fe+O_{2}\rightarrow FeO\)
- \(ZnS+O_{2}\rightarrow ZnO+SO_{2}\)
- \(Fe+O_{2}\rightarrow Fe_{3}O_{4}\)
- \(BaO_{2}\rightarrow BaO+O_{2}\)
- \(Fe_{2}O_{3}+Al\rightarrow Al_{2}O_{3}+Fe\)
- \(NH_{3}+O_{2}\rightarrow NO+H_{2}O\)
- \(NO_{2}+H_{2}O+O_{2}\rightarrow HNO_{3}\)
- \(FeCO_{3}+O_{2}\rightarrow Fe_{2}O_{3}+CO_{2}\)
- \(NaOH+H_{2}CO_{3}\rightarrow Na_{2}CO_{3}+H_{2}O\)
- \(Cu_{2}S+Fe\rightarrow Cu+FeS\)
- \(Cl_{2}+KBr\rightarrow KCl+Br_{2}\)
- \(CuO+Fe\rightarrow Cu+Fe_{3}O_{4}\)
- \(NH_{3}+CO_{2}+H_{2}O+CaSO_{4}\rightarrow CaCO_{3}+(NH_{4})_{2}SO_{4}\)
- \(Pb(NO_{3})_{2}\rightarrow PbO+NO_{2}+O_{2}\)
- \(KMnO_{4}+HCl\rightarrow KCl+H_{2}O+MnCl_{2}+Cl_{2}\)
- \(FeS_{2}+O_{2}\rightarrow Fe_{2}O_{3}+SO_{2}\)
- \(Pb_{3}O_{4}+Al\rightarrow Al_{2}O_{3}+Pb\)
- \(Al(OH)_{3}+H_{2}SO_{4}\rightarrow Al_{2}(SO_{4})_{3}+H_{2}O\)
- \(C_{6}H_{12}O_{6}+O_{2}\rightarrow CO_{2}+H_{2}O\)
- \(H_{3}PO_{4}+Ca(OH)_{2}\rightarrow Ca_{3}(PO_{4})_{2}+H_{2}O\)
- \(I_{2}+Cl_{2}+H_{2}O\rightarrow HIO_{3}+HCl\)
- \(PbO_{2}+HI\rightarrow PbI_{2}+I_{2}+H_{2}O\)
- \(C_{6}H_{6}+O_{2}\rightarrow CO_{2}+H_{2}O\)
Redoxreaktionen
Zink reagiert mit Sauerstoff und es entsteht Zinkoxid: \(2Zn+O_{2}\rightarrow 2ZnO\). Bei dieser Reaktion entstehen zunächst \(Zn^{2+}\)- und \(O^{2-}\)-Ionen:
- \(2Zn\rightarrow 2Zn^{2+}+4e^{-}\) (Elektronenabgabe)
- \(O_{2}+4e^{-}\rightarrow 2O^{2-}\) (Elektronenaufnahme)
Diese Reaktion ist eine Redoxreaktion, weil ein Elektronenaustausch zwischen den Reaktionspartner stattfindet.
Die Anzahl der abgegebenen und der aufgenommenen Elektronen muss dabei immer gleich sein. Ein Stoff, der Elektronen abgibt, wird Reduktionsmittel genannt. Ein Stoff, der Elektronen aufnimmt, wird Oxidationsmittel genannt. Elektronenaufnahme wird Reduktion genannt. Elektronenabgabe wird Oxidation genannt. Atome geben nur dann Elektronen ab, wenn gleichzeitig Reaktionspartner diese Elektronen aufnehmen. Jede Oxidation verlangt eine gleichzeitige Reduktion und umgekehrt.
Reaktion zwischen Zink und Chlor:
- Oxidation: \(Zn\rightarrow Zn^{2+}+2e^{-}\) ; \(Zn\) ist Reduktionsmittel.
- Reduktion: \(Cl_{2}+2e^{-}\rightarrow 2Cl^{-}\) ; \(Cl_{2}\) ist Oxidationsmittel.
- Redoxreaktion: \(Zn+Cl_{2}\rightarrow ZnCl_{2}\)
Aufgabe 2
Notieren Sie folgende Redoxreaktionen.
- Reaktion zwischen Aluminium und Sauerstoff zu \(Al_{2}O_{3}\).
- Elementares Kupfer \(Cu\) wird in salpetersaure Lösung \(HNO_{3}\) gegeben. Hierbei entstehen Kupfer-Ionen \(Cu^{2+}\) sowie Stickstoffmonoxid \(NO\):
\(Cu+HNO_{3}\rightarrow Cu^{2+}+NO\).
- Iodid-Ionen \(I^{-}\) reagieren in saurer Lösung mit Bromat-Ionen \(BrO_{3}^{-}\) unter Bildung von Iod-Molekülen \(I_{2}\) und Bromid-Ionen \(Br^{-}\).
- Permanganat \(MnO_{4}^{-}\) und Iodid \(I^{-}\) reagieren in basisch wässriger Lösung. Es entsteht Manganat \(MnO_{4}^{2-}\) und Periodat \(IO_{4}^{-}\):
\(MnO_{4}^{-}+I^{-}\rightarrow MnO_{4}^{2-}+IO_{4}^{-}\).