Die Atombindung¶
Edelgase (8. Hauptgruppe) sind sehr reaktionsträge und kommen nur atomar vor. Ursache: Das äußerste \(s\)- oder das \(p\)-Orbital ist vollständig besetzt. Andere Elemente versuchen auch, einen energieärmeren Zustand zu erreichen. Dazu gehen sie mit geeigneten Partnern Verbindungen ein, um so zu edelgasähnlichen Elektronenkonfigurationen zu gelangen. Deshalb besteht das Wasserstoffmolekül aus zwei Atomen.

Wasserstoffmolekül¶
Die beiden Wasserstoffatome überlappen sich und beide Elektronen sind im Anziehungsbereich beider Atomkerne. Die Elektronen halten sich bevorzugt zwischen den Atomkernen auf und es entsteht eine Zone hoher negativer Ladung. Der Abstand zwischen den Atomkernen ist ein Kompromiss zwischen der Anziehung der Kerne und Elektronen und Abstoßung der Kerne.
Im Wasserstoffmolekül liegt für die beiden Atome eine Edelgaskonfiguration vor, da jedes Atom das Elektron des Bindungspartners mit beansprucht. Eine Bindung, die durch Überlappung halbbesetzter Orbitale entstanden ist, wird Elektronenpaarbindung, kovalente Bindung oder Atombindung genannt.
Die Bindungsenergie ist die Energie, die zur Spaltung einer Atombindung aufgebraucht werden muss. Bei der Bildung eines Wasserstofffluoridmoleküls überlappen das einfach besetzte \(p\)-Orbital des Fluoratoms und das einfach besetzte \(s\)-Orbital des Wasserstoffatoms.
Die Valenzstrichformel von \(HF\) hat die Form: \(H-\underline{\overline{F}}|\).
Verbinden sich zwei Chloratome, so entsteht das Chlormolekül \(Cl_{2}\) mit der Valenzstrichformel: \(|\underline{\overline{Cl}}-\underline{\overline{Cl}}|\).
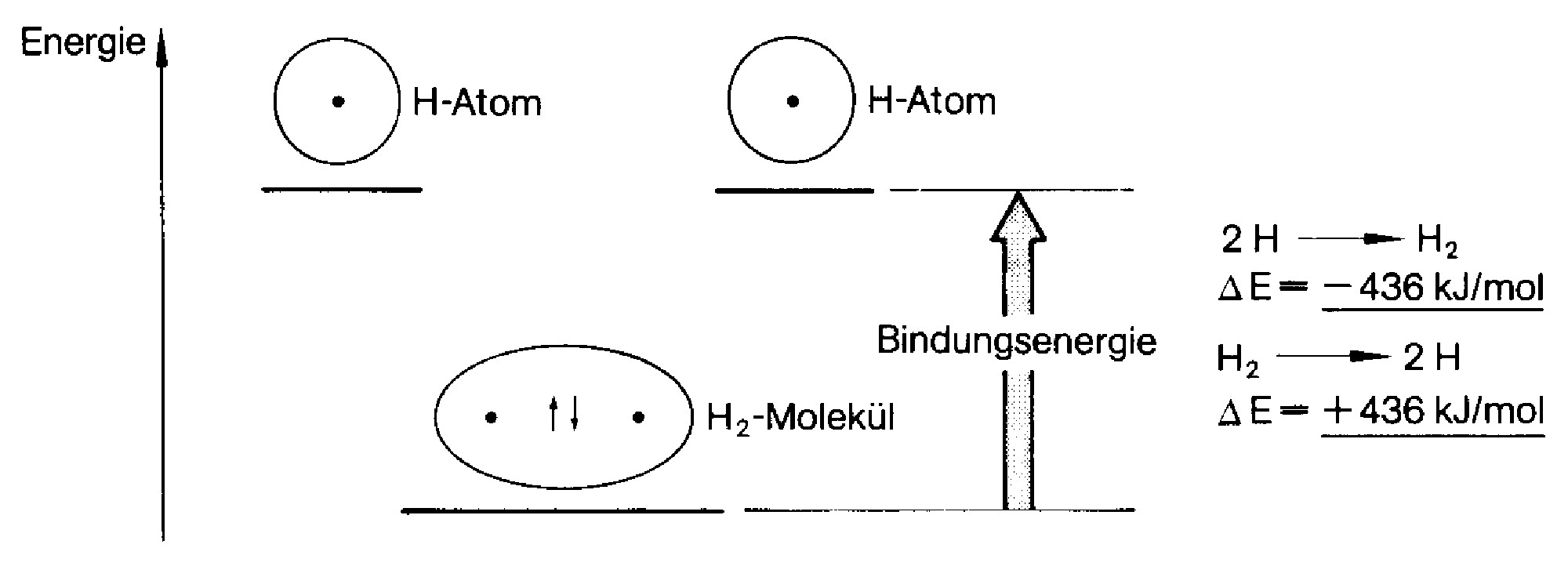
Bindungsenergie¶
Aufgabe 1
Zeichnen Sie Valenzstrichformeln von:
- \(H_{2}O\) ; \(N_{2}\) ; \(N_{2}H_{4}\) ; \(F_{2}\) ; \(HCl\) ; \(CH_{4}\) ; \(C_{2}H_{6}\) ; \(C_{2}H_{4}\) ; \(C_{2}H_{2}\) ; \(HCN\) und
- \(CH_{2}O\) ; \(OF_{2}\) ; \(SCN^{-}\) ; \(NO_{2}^{+}\) ; \(NH_{4}^{+}\) ; \(PO_{3}^{3-}\) ; \(HSO_{3}^{-}\).
Die polare Atombindung
In einer Atombindung zwischen gleichen Atomen sind die Bindungselektronen symmetrisch verteilt. Das Molekül ist nach außen elektrisch neutral und die Bindung ist unpolar. Bei Atombindungen unterschiedlicher Elemente ist dies nicht immer der Fall.
Im Chlorwasserstoffatom sind die Bindungselektronen zum Chloratom hin verschoben. Am Chloratom tritt eine schwache negative Teilladung \(\delta ^{-}\) auf. Am Wasserstoffatom tritt eine schwache positive Teilladung \(\delta ^{+}\) auf (\(H^{\delta +}-\underline{\overline{Cl}}|^{\delta -}\)). Eine derartige Atombindung heißt polare Atombindung. Da das Chloratom die größere Elektronegativität zieht es die Bindungselektronen stärker an sich heran.
Die Elektronegativität (EN) ist ein Maß für die Fähigkeit der Atome, Bindungselektronen in einer chemischen Bindung an sich zu ziehen. Das elektronegativste Element ist Fluor und Fluor hat den EN-Wert \(4\). Die Werte aller anderen Elemente wurden relativ dazu ermittelt. Innerhalb einer Hauptgruppe nimmt die EN von oben nach unten ab. Innerhalb der Periode steigt die EN von links nach rechts an.

Elektronegativität¶
Ein Molekül mit einer ausgeprägten positiven und negativen Seite ist ein Dipol. Benachbarte Dipole ziehen sich mit entgegengesetzt geladenen Seiten an. Dipol-Moleküle haben höhere Schmelz- und Siedepunkte als unpolar gebundene Stoffe. Das bekannteste Beispiel für ein Dipol ist des Wassermolekül.

Wassermolekül¶
Die Wasserstoffbrückenbindung
Zwischen den partiell positiv geladenen Wasserstoffatomen und den partiell negativ geladenen Sauerstoffatomen wirken elektrische Anziehungskräfte. Im Wasser lagern sich die Moleküle aneinander und kommen nicht isoliert vor. Diese Bindung der Moleküle heißt Wasserstoffbrückenbindung.
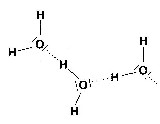
Wasserstoffbrückenbindung¶
Die Stärke der Wasserstoffbrückenbindung beträgt etwa \(\frac{1}{10}\) bis \(\frac{1}{20}\) der Elektronenpaarbindung. Eine Folge davon ist der hohe Siedepunkt des Wassers. Man benötigt viel Energie, um die Wasserstoffbrückenbindungen zu zerstören. Im Eis ordnen sich die Wassermoleküle in einer tetraedrischen Koordination an. Dabei ist jedes Wassermolekül von vier weiteren Wassermolekülen umgeben.
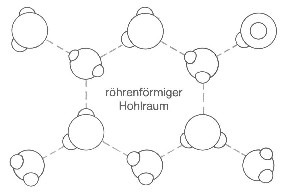
Hohlraum¶
Wird das Eis geschmolzen, bricht diese netzartige Struktur zusammen. Wasserstoffbrückenbindungen brechen auf und die Moleküle kommen einander näher als im Eis. Bei einer Temperatur von \(4\,\mathrm{^{\circ}C}\) ist die Dichte des Wassers am größten. Wird die Temperatur erhöht, sinkt die Dichte wieder. Dies ist eine Folge der Volumenausdehnung des Wassers. Die Volumenausdehnung, wird durch die thermische Bewegung der Moleküle verursacht.